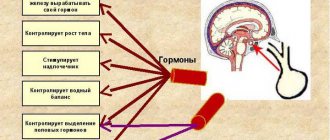
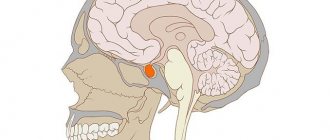
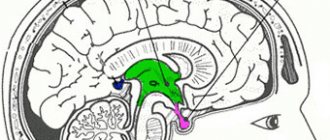
Гипофиз – это сложнейший орган человеческого организма, который отвечает за нейроэндокринную регуляцию. Располагается он у основания черепа в турецком седле и имеет три доли, которые вырабатывают разные гормоны.
Гипофиз, так же называемый мозговым придатком или питуитарной железой, имея столь крошечные размеры (его масса равна всего 0,5-1г), обладает весомой значимостью для всего человеческого организма. Неоднородная структура гипофиза приводит к сбою в работе внутренних органов и систем.
Объясняется это тем, что производимые им жизненно необходимые гормоны, такие как пролактин, соматотропин, гликопротеины, эндорфины и прочие, оказывают действие на работу всего человеческого организма.
Причины возникновения
Неоднородность гипофиза связана с появлением уплотнений: кист, аденоидов и опухолей. Возникновение аденомы происходит при формировании гормонов клетками гипофиза. Может развиться у женщин и мужчин в возрасте от 25 до 50 лет, очень редко появляется у детей.
Киста бывает врождённая и приобретённая и представляет собой небольшой пузырёк с жидкостью. Чаще всего это доброкачественные образования. Однако, если их не лечить, они, как правило, перерастают в злокачественные опухоли или аденокарциномы.
Какие бывают осложнения, и каких мер профилактики придерживаются?
Если лечение было неправильным либо болезнь запущена это провоцирует:
- абсцесс;
- раковое образование;
- шоковое состояние;
- внутреннее кровотечение;
- дуоденальный стеноз;
- плеврит.
Для избавления от проблем с органом стоит серьезно откорректировать питание. Важно уменьшить либо вовсе исключить продукты, раздражающие орган. Питание больного сделать полноценным и сбалансированным. А также отказаться от никотина и спиртного, заняться физическими упражнениями, вести здоровый образ жизни.
Симптомы
Как правило, болезнь никак не ощущается. Симптомы отклонения могут начать проявляться при увеличении новообразований. Признаками такого заболевания являются:
- Уменьшение поля видимости и резкое ухудшение зрения.
- Регулярно появляющиеся головные боли с локализацией в разных местах.
- Нарушение моторики глазных яблок.
- Сбой менструального цикла и половая дисфункция, связанные с нарушением гормонального фона.
- Появление неврологических отклонений: онемение, судороги, приступы эпилепсии.
- Нарушение суточного ритма и плохой сон.
- Потеря ориентации в пространстве.
Что значит диффузная неоднородность ткани
Гипофиз имеет небольшие размеры и массу, составляющую всего 0,5-1 гр. Чтобы определить любые отклонения, требуется проведение УЗИ или томографии. Результаты обследования могут указать, что структура гипофиза при исследовании диффузно-неоднородная. Что означает этот диагноз?
Почему гипофиз имеет неоднородную структуру
Диагноз диффузная неоднородность ткани, указывает на неодинаковые отражающие свойства тканей. Причиной этого являются:
Аденомы.
- Кистозные образования.
- Опухоли.
Следовательно, структурная неоднородность гипофиза значит, что в некоторых участках ткань имеет уплотнения. В большинстве случаев речь идет о доброкачественном образовании. Но при отсутствии должного лечения, возможно перерождение тканей и образование аденокарциномы, злокачественной опухоли. Происходит это крайне редко, но опасность перерождения все же существует.
Признаки неоднородной структуры питуитарной железы
Мелкоочаговая неоднородность, зачастую не проявляется. Симптоматика заболевания появляется при тенденции к увеличению опухоли. Признаки указывают на локализацию уплотнения.
Основными симптомами заболевания являются:
- Резкое ухудшение зрения – сначала уменьшается поле видимости. При посещении офтальмолога обнаруживается ухудшение моторики глазного яблока.
Головные боли – не снимаются обычными анальгетиками.
- Неврологические признаки – опухоль больших размеров приводит к появлению судорог, онемения, эпилептических припадков.
- Изменения гормонального фона – последствием неоднородности ткани питуитарной железы является половая дисфункция, нарушения менструального цикла, неспособность забеременеть.
Дополнительными признаками, указывающими, что присутствует неоднородность гипофиза, является нарушение суточных ритмов человека, бессонница, в тяжелых случаях, потеря ориентации в пространстве.
Чем страшна диффузная неоднородность
Неоднородная структура питуитарной железы говорит о том, что в области гипофиза развивается опухолевое новообразование. Последствия развития возникшей аномалии зависят от ее природы, объема и степени злокачественности.
Как определяется
В связи с малыми размерами гипофиза, обнаружить его диффузное отклонение довольно сложно. С такой задачей справляются ультразвуковое исследование и МРТ. Только благодаря современным методикам можно обнаружить степень плотности тканей гипофиза и выявить факт развития узлов, аденом и прочих новообразований.
Результатом эхокартины УЗИ и магнитной томографии является описание структуры гипофиза. Положительным считается результат исследования, заключение в котором звучит как «эхоструктура гипофиза однородна, без изменений».
Диагноз «неоднородная структура» указывает на имеющиеся отклонения в гипофизе. Как правило, указывается точное место образований и обозначается его размер.
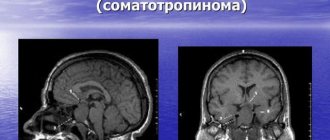
МРТ гипофиза: как выглядит орган в нормальном состоянии
В первую очередь, практикующие доктора должны знать характеристики нормальных показателей при проведении МРТ гипофиза:
- во фронтальной плоскости форма гипофиза близка к прямоугольной;
- нижний контур гипофиза повторяет форму турецкого седла, а верхний может быть горизонтальным, выпуклым или вогнутым;
- в сагиттальной плоскости форма нормального гипофиза эллипсоидная, его доли хорошо дифференцируются;
- сагиттальный и поперечный размеры определяются размерами турецкого седла, а вертикальный – около 4-8 мм;
- на фронтальных разрезах гипофиз зачастую симметричен;
- воронка гипофиза в норме чаще всего располагается по средней линии.
Последствия неоднородной структуры гипофиза
Неоднородной структура становится с момента образования различных уплотнений. Последствия такого состояние питуитарной железы зависят от причины её возникновения, степени и объёма злокачественности.
Пациент с мельчайшими образованиями (размеры аденоид варьируются в пределах до 10 мм) практически не испытывает дискомфорта, либо он проявляется кратковременно.
При росте новообразований могут возникнуть следующие симптомы:
- Стремительное ухудшение зрения и даже полная его потеря;
- Головокружения и нарушение координации;
- Онемение конечностей;
- Приступы эпилепсии;
- Расстройство половой и репродуктивной системы.
В случае быстрого роста злокачественных образований, пациенту озвучивают неутешительный прогноз. Чаще всего в зону риска попадают люди с гипертонией, лишним весом, диабетики. Диффузные изменения гипофиза больше всего имеют негативные последствия для половой системы организма.
Так, для женщин это сбой в менструальном цикле и проблематичное зачатие. Мужчины с таким диагнозом испытывают эректильную дисфункцию.
У детей изменения в структуре гипофиза связаны с гигантизмом и карликовостью (при излишке и нехватке соматотропина).
С чем может быть связана гипотрофия гипофиза
Основными причинами, приводящими к гипотрофии гипофиза, являются:
- врожденная патология, которая приводит к сдавливанию этой железы окружающими тканями мозга,
- повышение внутричерепного давления,
- менопауза после частых беременностей, заканчивающихся абортами,
- ишемический некроз гипофиза (синдром Симмондса), связанный с массивным кровотечением во время родов,
- аутоиммунные процессы,
- оперативные вмешательства или лучевая терапия этой области мозга.
Интересно, что при беременности гипофиз значительно увеличивается в размерах, не всегда возвращаясь к исходному состоянию после родов. Поэтому во время возрастной инволюции может наступить его значительное уменьшение.
Как правильно провести диагностику
Появление неврологических симптомов не является стопроцентным следствием неоднородной структуры питуитарной железы. Для исключения других причин недомогания, необходимо пройти несколько процедур диагностики:
- Радиоиммунологическое исследование крови, выявляющее в ней уровень гормонов.
- УЗИ. Это первостепенная процедура особенно для новорождённых детей.
- Магнитно-резонансная томография. В современной медицине это самый информативный способ диагностики. Позволяет обнаружить уплотнения размером всего лишь в несколько миллиметров при неоднородной структуре органа.
Благодаря объёмному изображению, структуру гипофиза можно рассмотреть более детально, увидев мельчайшие изменения и тенденции к деформации.
При подозрении на развитие злокачественных опухолей, необходимо обследование на томографе при помощи маркера. Такая процедура помогает выявить характер новообразования.
Признаки опухолевых образований при проведении МРТ гипофиза
При проведении МРТ гипофиза хорошо визуализируются такие признаки опухолей хиазмально-селлярной области: деформация дна турецкого седла, асимметрия и выбухание контура гипофиза, смещение воронки, неоднородность структуры органа. Все эти признаки не указывают однозначно на наличие опухоли, поэтому их необходимо анализировать вместе с результатами динамического наблюдения и особенностями клинической картины патологии у конкретного пациента. По характеру распространения опухоли гипофиза разделяются следующим образом:
- эндоселлярные – не выходят за пределы турецкого седла;
- супраселлярные – растут в супраселлярную цистерну;
- параселлярные – растут в кавернозные синусы;
- инфраселлярные – растут в пазуху основной кости;
- ретроселлярные – прорастают в цистерну мозга, разрушая спинку турецкого седла;
- антеселлярные – растут в ячейки решетчатого лабиринта, медиобазальные отделы лобных долей и носовые ходы.
Методы терапии
Зачастую диагностировать неоднородную структуру получается лишь в той ситуации, когда выросшие уплотнения начинают воздействовать на соседние ткани. Чтобы подобрать корректное лечение, врачу необходимо изучить результаты всех анализов, а пациенту пройти обследование на томографе.
Если объём уплотнения небольшой, как правило, назначается регулярный контроль над его увеличением. Если тенденция к росту опухолевых клеток не обнаруживается, необходимости в медикаментозном лечении нет.
Терапию медицинскими препаратами должен назначить только лечащий врач. При верно подобранном блокирующем лечении приостанавливаются и даже устраняются многие последствия болезни: можно восстановить потенцию и репродуктивные способности.
Профилактические мероприятия и консервативная терапия могут остановить рост новообразований и сбалансировать гормональный фон пациента. Виды уплотнений, не поддающиеся медикаментозному лечению, удаляются в процессе хирургического вмешательства и последующей лучевой терапии.
Залогом полного выздоровления или стабилизации работы гипофиза является раннее обращение за квалифицированной медицинской помощью. Нормальная работа этого отдела головного мозга определяет здоровье пациента и функционирование внутренних систем организма.
Признаки неопухолевых патологий при проведении МРТ гипофиза
В зависимости от полученных результатов проведения МРТ гипофиза, можно заподозрить такие неопухолевые патологии этого органа:
- истончение гипофиза, его распластанность по дну турецкого седла за счет провисания цистерны перекреста позволяет заподозрить синдром пустого турецкого седла;
- при наличии несахарного диабета у пациента могут наблюдаться признаки воспалительного или опухолевого поражения гипоталамо-гипофизарной системы, а также отсутствие гиперинтенсивного сигнала от нейрогипофиза при идиопатическом несахарном диабете;
- эктопия нейрогипофиза, гипоплазия аденогипофиза, и аплазия или гипоплазия гипофизарной ножки в большинстве случаев являются признаками СТГ-недостаточности.
Поделитесь:
Неактивные аденомы гипофиза и патология репродуктивной системы у женщин
В.Г. Шлыкова, А.А. Пищулин, А.А. Булатов
Эндокринологический научный центр РАМН, Москва
Дан анализ современных представлений о механизмах развития «неактивных» аденом гипофиза (НАГ), клинически не проявляющихся симптомами гиперсекреции гипофизарных гормонов. Частота сочетания НАГ и нарушений репродуктивной функции женщины, в первую очередь, синдрома поликистозных яичников, свидетельствует о патогенетической связи между данными видами патологии. С этих позиций рассматриваются вопросы диагностики НАГ, подходы к лечению патологии репродуктивной системы в сочетании с НАГ, а также самой аденомы гипофиза.
Аденомы гипофиза — доброкачественные опухоли аденогипофиза, которые составляют около 15 % всех внутричерепных опухолей [8, 66]. На аутопсии аденомы гипофиза
обнаруживают у 10-20% умерших от не связанных с поражением гипофиза болезней.
Аденомы гипофиза
, протекающие без клинических проявлений гиперсекреции гипофизарных гормонов, называют «неактивными» (non-active) аденомами гипофиза (НАГ). В литературе применяются также термины «клинически нефункционирующие» аденомы (clinically nonfunctioning adenomas) или «молчащие» (silent) аденомы. НАГ составляют 25-30 % всех опухолей гипофиза [39], тогда как при супраселлярной локализации их процент возрастает до 70 [50, 55].
Следует различать понятия НАГ и «инциденталомы», последнее нередко встречается в зарубежной литературе [51]. Инциденталомы (incident-случайность) — опухолевые образования, обнаруживаемые в каком-либо органе случайно при более детальном обследовании пациента. Гипофизарные инциденталомы
могут быть как НАГ, так и
гормонально активными аденомами
, например,
пролактиномами
.
Аденомы гипофиза классифицируют по морфологическим характеристикам, гормональной активности, степени распространения [66]. По размерам опухоли гипофиза разделяют на микроаденомы (менее 1 см в диаметре) с интраселлярным ростом и макроаденомы с супраселлярным распространением (диаметр более 1 см).
У женщин НАГ нередко сочетаются с патологией репродуктивной системы. У 88% женщин с НАГ выявляется синдром поликистозных яичников (СПKЯ), у 23% — вторичный гипогонадизм с аменореей [4]. Чаще к гинекологу обращаются пациентки, у которых имеются микроаденомы гипофиза, поскольку при больших размерах опухоли ведущими являются неврологические и офтальмологические нарушения, а нарушения со стороны репродуктивной системы отходят на второй план.
В настоящей статье рассматриваются патогенетические связи между НАГ и патологией репродуктивной системы у женщин, вопросы диагностики НАГ, а также подходы к лечению патологии репродуктивной системы при НАГ и самой аденомы гипофиза.
Патогенез НАГ и его связи с патологией репродуктивной системы
По современным представлениям, основанным на достижениях молекулярной биологии, аденомы гипофиза, в том числе НАГ, являются продуктом моноклональной пролиферации генетически трансформированных соматических клеток [39, 58, 66]. Однако развитие опухоли гипофиза — многоэтапный процесс, в который вовлекаются, наряду с соматическими мутациями в гипофизарных клетках, многие другие дополнительные факторы — гормональные, аутокринные и паракринные. Важными патогенетическими факторами, участвующими в туморогенезе в гипофизе, являются гормоны гипоталамуса, нейромедиаторы и факторы роста [16, 32, 58, 66]. Вместе с тем следует подчеркнуть, что нарушения гипоталамической регуляции и другие указанные факторы в отличие от онкогенных мутаций скорее всего лишь способствуют развитию опухоли гипофиза, но не являются ее непосредственной причиной.
Поскольку доказано, что клетки гипофиза способны вырабатывать различные ростовые факторы, в том числе основной фактор роста фибробластов, обладающий мощным митогенным и ангиогенным потенциалом, и имеют соответствующие рецепторы [66], возможность участия ростовых факторов в патогенезе гипофизарных опухолей не вызывает сомнения.
Хотя клинические признаки гормональной гиперсекреции при НАГ отсутствуют, такие опухоли, по данным гистоморфологического и молекулярно-биологического исследования, а также исследований на клеточных культурах, имеют необходимые органеллы для синтеза гормонов и способны к их синтезу и секреции [7, 17]. НАГ могут развиваться из разных клеток аденогипофиза, однако чаще всего они происходят из гонадотрофов. Более 80% этих опухолей синтезируют лютеинизирующий (ЛГ) и/или фолликулостимулирующий (ФСГ) гормоны или их свободные — или -субъединицы. «Немые» кортикотрофные, соматотрофные или лактотрофные аденомы обнаруживаются значительно реже [43]. В 90% случаев в клетках НАГ обнаруживаются белки секреторных гранул — хромогранины А и В и секретогранин 2 [41, 45].
Как отмечено выше, наибольшая доля в структуре репродуктивной патологии при НАГ принадлежит СПКЯ. Рассмотрим современные представления о патогенезе этого заболевания. Согласно одной из теорий, СПКЯ развивается в результате «порочного» цикла образования андростендиона [31, 48]. Последний может частично продуцироваться в надпочечниках и ароматизируется на периферии в эстрон. Повышение уровня эстрона в крови приводит к увеличению секреции ЛГ гонадотрофами гипофиза. ЛГ, в свою очередь, вызывает или поддерживает повышенную овариальную секрецию андростендиона. Вторая, альтернативная, теория рассматривает СПКЯ как форму функциональной гонадотропин-зависимой овариальной гиперандрогении [31]. По этой теории основу нарушений при СПКЯ составляет повышение внутрияичниковой концентрации андрогенов. Локальное повышение уровня андрогенов способствует фолликулярной атрезии и ответственно за ановуляцию как результат прямого действия андрогенов на яичник. Андрогены, попадая в кровеносное русло, вызывают вирилизирующие изменения, развитие гирсутизма. Процессы, способные приводить к повышению уровня андрогенов в яичниках, включают атрезию фолликулов, которая может быть как причиной, так и результатом избытка андрогенов, повышение продукции андрогенов вне яичников, дефекты в биосинтезе эстрогенов из андрогенов в яичниках и дисрегуляцию секреции андрогенов, которая может быть результатом как избыточной секреции ЛГ гипофизом, так и усиления действия ЛГ инсулином, инсулиноподобными и другими ростовыми факторами [31].
СПКЯ может сочетаться с гиперинсулинемией и инсулинорезистентностью [28, 61]. Описаны следующие эффекты инсулина в яичниках [31]: 1) стимуляция in vitro андрогенной секреции стромой яичников у женщин с гиперандрогенией; 2) его синергизм с ЛГ в стимуляции андрогенной продукции яичниками in vitro, осуществляющийся непосредственно через инсулиновые рецепторы (мРНК инсулиновых рецепторов найдена в яичнике на всех стадиях развития фолликулов в яичнике); 3) повышение продукции андрогенов за счет влияния на сложную интраовариальную систему инсулиноподобных ростовых факторов (ИРФ) и связывающих их белков. Кроме того, инсулин способен понижать сывороточную концентрацию сексгормонсвязывающего глобулина (СГСГ), что приводит к повышению уровня свободного тестостерона в крови. Участие ростовых факторов в патогенезе как СПКЯ, так и НАГ указывает на сходство их базовых механизмов.
При НАГ, кроме СПКЯ может наблюдаться гипогонадизм и выявляться функциональная гиперпролактинемия [39]. Механизм развития этих изменений при больших размерах аденомы состоит в сдавлении и повреждении опухолью клеток, продуцирующих гонадотропины и/или пролактин (ПРЛ). Второй из возможных причин нарушения патологии репродуктивной функции при НАГ является «феномен пересеченной ножки» — сдавление макроаденомой портальных сосудов гипофиза и нарушение гипоталамо-гипофизарных связей. Гипогонадизм может быть обусловлен ингибирующим влиянием ПРЛ на продукцию гонадотропинов, прогестерона и эстрогенов, а также на процесс лютеинизации [5]. После оперативного удаления опухоли происходит декомпрессия клеток гипофиза и гормональный статус нередко восстанавливается. Однако когда изменения гормонального статуса связаны с ишемическим некрозом клеток гипофиза, восстановительные возможности после операции ограничены. В ткани самой опухоли также может происходить апоплексия и склерозирование (часто при длительной терапии препаратами бромокриптина). В этих случаях клинически отмечается ремиссия, а при компьютерной или магнитно-резонансной томографии (соответственно КТ или МРТ) в области гипофиза диагностируется функционально неактивная кистозная аденома.
Нарушения функции репродуктивной системы при НАГ могут быть обусловлены аномальной, нециклической продукцией гонадотропинов или их субъединиц клетками аденомы. Физиологическая роль свободных субъединиц гонадотропинов остается неясной. Однако в литературе появились данные, позволяющие предполагать возможность самостоятельного влияния -субъединицы гликопротеиновых гормонов нарепродуктивную систему [52].
Определенная роль в патогенезе НАГ может принадлежать периферическим звеньям в системе обратной связи яичники — гипоталамус — гипофиз. Известно, что хроническая гиперэстрогения приводит к гиперплазии клеток гипофиза и может вызывать развитие аденомы [34]. Вероятно, состояния, сопровождающиеся повышением содержания эстрогенов в крови (в их числе СПКЯ), могут способствовать развитию аденом гипофиза.
Все виды физиологической (менопауза) или патологической (синдром истощенных или резистентных яичников) гипофункции яичников приводят к стимуляции секреции гонадотропинов гипофизом, а подобная нагрузка на клетки гипофиза может быть причиной компенсаторной клеточной гиперплазии и, возможно, способствует развитию аденомы. В целом анализ механизмов развития НАГ и нередко сочетающихся с ними нарушений репродуктивной функции, в первую очередь СПКЯ, свидетельствует о существовании патогенетической взаимосвязи этих видов патологии, что необходимо учитывать при их диагностике и лечении.
Диагностика НАГ В отличие от гормонально-активных аденом, НАГ не имеют каких-либо специфических клинических симптомов и не проявляются классическими синдромами гиперсекреции гормонов (болезнь Иценко-Кушинга, акромегалия и др.)
Небольшие НАГ чаще выявляются как находка при рентгенографии черепа.
Микроаденомы ( в том числе нефункционирующие), в отличие от макроаденом, не проявляются симптомами сдавления опухолью окружающих тканей (неврологическими и глазными симптомами), однако, как и при больших опухолях, может наблюдаться гиперпролактинемия, происхождение которой пока гипотетично.
Эндокринным проявлением НАГ может быть частичный или полный (при макроаденомах) гипопитуитаризм [41, 50, 55]. Нередко следствием этого являются расстройства менструального цикла, ановуляция и бесплодие, снижение либидо.
Несмотря на ведущую роль в диагностике НАГ инструментальных методов обследования, анамнестические и клинические данные помогают диагностировать наличие аденомы на более ранних этапах заболевания. При обследовании немецкими авторами 517 пациентов (из них 311 женщин) установлено, что среднее анамнестическое время при НАГ у женщин составило около 2 лет, что значительно больше, чем у мужчин (1 год) [64].
При этом наиболее частыми начальными симптомами явились олиго- или аменорея (у 57,9% пациенток), дефекты полей зрения (у 11,6% больных), головная боль (у 11,3%). По данным других авторов [14], менструальные нарушения могут иметь место у 78,3% больных с НАГ.
Наиболее часто встречающаяся при НАГ патология репродуктивной системы — СПКЯ. Данный синдром включает целый спектр симптомов, среди которых чаще встречаются опсоменорея, бесплодие, гирсутизм и метаболические изменения [38].
При обследовании таких больных выявляются хроническая ановуляция, повышенное отношение ЛГ/ФСГ (» 2) и гиперандрогения [48]. В последние годы установлено, что при СПКЯ нередко возникают инсулинорезистентность и гиперинсулинемия [24, 29].
Ведущая роль в выявлении НАГ принадлежит методам лучевой диагностики. При рентгено-краниографии оценивают признаки повышенного внутричерепного давления и состояние турецкого седла, участки обызвествления. Двуконтурность турецкого седла, остеопороз и(или) отклонение спинки при сохраненных размерах турецкого седла указывают на вероятность наличия микроаденомы гипофиза [3].
Для более точной диагностики используется КТ или МРТ, при этом предпочтение отдается МРТ c контрастированием гадолиниумом [47, 62, 68]. Для решения спорных вопросов рекомендуется проведение МРТ с контрастированием в динамике [49]. Имеются результаты успешного применения для диагностики микроаденом гипофиза позитронно-эмиссионной томографии [8]. Однако вопросы дифференциальной диагностики между НАГ и гормонально-активными аденомами остаются за пределами возможностей методов визуализации.
При исследовании гормонального статуса в сыворотке крови больных с НАГ может отмечаться некоторое повышение уровня ФСГ, -ФСГ, -субъединицы и реже ЛГ [1, 2, 33, 39]. ЛГ-секретирующие опухоли редки, но в этом случае может отмечаться повышение уровня тестостерона. Уровень ФСГ в сыворотке крови оказывается повышенным примерно у 15% пациентов, что в 48% случаев сочетается с секрецией -субъединицы. Аденомы, секретирующие только -субъединицу, встречаются в 7% случаев [39]. Существенное значение в дифференциальной диагностике НАГ имеют функциональные фармакодинамические пробы. В их числе пробы с использованием препаратов, стимулирующих секрецию ПРЛ (с метоклопрамидом, тиролиберином, сульпиридом, хлорпромазином, инсулиновой гипогликемией, циметидином). С целью изучения функциональных резервов тропных гормонов гипофиза и для ранней диагностики микроаденом применяют пробы с тиролиберином (тиреотропин-рилизинг-гормон — ТРГ) — исследуют реакцию тиреотропного гормона (ТТГ), ПРЛ, соматотропного гормона (СТГ); с люлиберином и эстрадиолом — определяют реакцию гонадотропинов; с глюкозой и аргинином — СТГ; с инсулином — СТГ и адренокортикотропного гормона (АКТГ); с метопироном и лизинвазопрессином — АКТГ. Большинство этих проб используется с научными целями, в клинической практике их применение ограничено [5].
Наиболее часто используют пробы с ТРГ и метоклопрамидом. Считается, что прирост уровня ПРЛ более чем в 3,5 раза на 20-30-й минуте пробы с ТРГ позволяет исключить наличие пролактиномы. При гиперпролактинемии неопухолевого генеза пик реакции ПРЛ на стимуляцию ТРГ может быть нормальным или сниженным, но суммарный прирост над исходным уровнем, как правило, выше, чем при гиперпролактинемии опухолевого генеза. При наличии пролактиномы реакция ПРЛ снижена или отсутствует. Есть сообщения, где отмечено влияние ТРГ на выделение гонадотропинов и -субъединицы гликопротеиновых гормонов у больных с НАГ [23, 39, 57].
Метоклопрамид (церукал), являясь антагонистом дофамина центрального действия, оказывает стимулирующее влияние на секрецию ПРЛ. В норме максимальная секреция ПРЛ на фоне пробы превышает исходную в 10-15 раз. Пролактинома обычно рефрактерна к метоклопрамиду, при этом базальный уровень ПРЛ оказывается выше (более 2000 мЕД/л), чем при НАГ. При функциональной гипепролактинемии реакция гормона на стимулятор может быть снижена [6].
Тест с люлиберином (ЛГ-рилизинг-гормон; ЛГРГ) или его аналогами позволяет исследовать функциональные резервы гонадотрофов гипофиза и прогнозировать эффект дальнейшей терапии этими препаратами.
Предпринимаются попытки установления маркеров, специфических для НАГ. На эту роль, как считают некоторые авторы, могут претендовать: -субъединица гликопротеиновых гормонов, хромогранины А и В и секретогранин 2 [1, 8]. Однако это является предметом дальнейшего изучения.
НАГ необходимо дифференцировать с гормонально-активными опухолями гипофиза (соматотропиномами, пролактиномами, АКТГ-секретирующими аденомами, тиреотропиномами, гонадотропиномами). Как было указано выше, в клинической картине небольших гормонально-активных инцинденталом классические симптомы гиперсекреции гипофизарных гормонов могут отсутствовать, а изменения гормонального статуса могут быть очень незначительными. НАГ также необходимо отличать от других опухолей и патологических процессов в центральной нервной системе и в области турецкого седла (краниофарингиомы, невриномы, метастатические очаги, различные виды обызвествлений, кисты, воспалительные процессы в гипофизе, опухоли нейрогипофиза и др.). Специального упоминания заслуживает сложность дифференциальной диагностики микроаденом гипофиза и аутоиммунного лимфоцитарного гипофизита, при котором (как и при КНАГ) может иметь место дефицит того или иного гормона гипофиза вплоть до пангипопитуитаризма [56, 60] или незначительная гиперсекреция гипофизарных гормонов (часто ПРЛ). Считается, что лимфоцитарный гипофизит — самостоятельный процесс, который не является осложнением аденомы гипофиза. Маловероятно также, что аденома может быть результатом предшествующего воспаления в ткани гипофиза. Диагноз лимфоцитарного гипофизита основывается на увеличении размеров гипофиза (по данным МРТ) и на данных пункционной биопсии гипофиза [60]. В качестве маркеров лимфоцитарного гипофизита рекомендуется определять антигипофизарные аутоантитела в крови, которые могут иметь место у пациентов еще в доклинической стадии. Для сохранения функции гипофиза в случае воспаления рекомендуется проведение глюкокортикоидной терапии, так как длительно существующий лимфоцитарный гипофизит приводит к атрофии гипофиза [25, 60]. Известны случаи сочетания лимфоцитарного гипофизита с микроаденомой, подтвержденные при биопсии, a в последнее время получены данные о возможном присутствии в крови пациентов с НАГ антигипофизарных аутоантител, которые, однако, нельзя рассматривать как маркеры опухоли.
Таким образом, визуальные методы диагностики НАГ не всегда достоверны, и, следовательно, необходим поиск путей наиболее точной верификации данной патологии.
Подходы к лечению патологии репродуктивной системы при НАГ
Поскольку основную долю в структуре патологии репродуктивной системы при НАГ составляет СПКЯ, рассмотрим подходы к терапии такой сочетанной патологии. Для лечения СПКЯ используются как консервативные, так и оперативные методы.
I. Консервативное лечение
Агонисты дофамина. При СПКЯ обнаружены нарушения моноаминергической регуляции с изменением соотношения нейромедиаторов (дофамина, серотонина, норадреналина), что может приводить к патологической секреции гонадотропин-рилизинг-гормона гипоталамусом [9, 20]. Хотя этот механизм при СПКЯ не является ведущим, терапия агонистами дофамина (парлодел, абергин) в некоторых случаях (чаще при наличии функциональной гиперпролактинемии) может приводить к нормализации функции яичников.
Эстроген-гестагенные препараты. При сочетании СПКЯ с НАГ особая осторожность должна соблюдаться при использовании препаратов, содержащих эстрадиол (например «Диане-35>), поскольку последний может не только вызывать гиперплазию лактотрофов, но и способствовать росту опухоли [34, 53]. В этом случае предпочтение следует отдавать гестагенным препаратам.
Стимуляторы овуляции. Индукция овуляции при СПКЯ, когда нередко имеет место хроническая ановуляция, может осуществляться кломифенцитратом (КЦ). Показано, что КЦ оказывает антиандрогенное влияние на разных уровнях гипоталамо-гипофизарно-яичниковой системы, но механизм, лежащий в основе индукции им овуляции, остается до конца неясным [12].
Считают, что КЦ блокирует рецепторы к эстрогенам в гипофизе и вызывает их десенсибилизацию. Действие КЦ зависит от исходного уровня эстрогенов в организме. При гиперэстрогении он проявляет выраженную антиэстрогенную активность, тогда как при сниженной эстрогенной насыщенности дает слабый эстрогенный эффект. Хотя применение КЦ у женщин с СПКЯ приводит к временному повышению уровня ЛГ и ФСГ в сыворотке крови [40, 67], только это оказывается недостаточным, чтобы вызвать инициацию фолликулогенеза и своевременную овуляцию. Отмечено, что через 2 дня от начала лечения КЦ уровень циркулирующего в крови ИРФ-1, который является сильным митогенным и метаболическим агентом, уменьшается на 30%, а уровень СГСГ повышается на 23% [22]. Это приводит к увеличению уровня ИРФ-1 в фолликуле [30]. ИРФ-1 в фолликуле в качестве аутокринного и паракринного стимулятора вместе с ФСГ усиливает активность ароматазы, увеличивая продукцию эстрогенов в клетках гранулезы, что приводит к созреванию фолликулов и овуляции [13]. За счет повышения уровня СГСГ уменьшается уровень биологически активных циркулирующих андрогенов и эстрогенов в клетках-мишенях.
Аналоги ЛГРГ.
В последние годы для лечения СПКЯ стали применять синтетические аналоги ЛГРГ, которые в то же время, по некоторым данным [46], могут уменьшать размеры НАГ. Однако, этот вид терапии недостаточно широко используется в практике из-за отсутствия полной определенности в вопросе влияния аналогов ЛГРГ на аденому, а также, возможно, из-за высокой стоимости этих препаратов. Продолжительное лечение аналогами ЛГРГ приводит к подавлению секреции гонадотропинов и снижает уровень овариальных андрогенов, а также индуцирует овуляцию после отмены препарата. Воздействие аналогов ЛГРГ объясняется так называемым феноменом «даун-регуляции>. Суть его в том, что длительное импульсное введение этих препаратов приводит к связыванию их с рецепторами ЛГРГ в гипофизе. В начале лечения часть рецепторов оказывается несвязанной и происходит постоянный ресинтез рецепторов (1-я фаза — стимуляции — характеризуется транзиторным повышением уровня ЛГ, ФСГ и половых стероидов в крови). При продолжении постоянного введения препарата (около 3 нед) рецепторы ЛГРГ перестают выявляться (2-я фаза — «десенситизации> и блокады секреции ЛГ). При терапии аналогами ЛГРГ значительно повышается уровень СГСГ в крови, что способствует оптимизации фолликулярной среды. Также повышается уровень ФСГ, снижается уровень ЛГ, тестостерона (Т) и андростендиона (А) в крови [65], что является важным фактором индукции овуляции. Наиболее благоприятны для улучшения овуляторной функции уменьшение отношения ЛГ/ФСГ и уровня Т и А в крови [36, 59]. В настоящее время изучается новая группа препаратов — антагонистов ЛГРГ, не дающих начальный стимулирующий эффект, а непосредственно, после первой инъекции, подавляющих секрецию ЛГ [37]. Возможно, их применение при сочетании СПКЯ и НАГ будет патогенетически более оправданным.
Также отмечено влияние аналогов ЛГРГ на белки, связывающие ИРФ. Снижение уровня ИРФ-связывающих белков при СПКЯ может увеличивать количество свободного ИРФ, который потенцирует ЛГ-индуцированный синтез андрогенов [26].
II. Оперативное лечение
Альтернативой консервативному лечению СПКЯ (при его неуспехе) долгое время считалась билатеральная клиновидная резекция яичников [63]. Однако несмотря на эффективность данного метода, при его использовании велика вероятность развития периовариальной адгезии, которая может вызвать механическое (трубно-перитонеальное) бесплодие [11].
В конце 80-х годов стал более популярен метод электрокаутеризации яичников [35]. Независимые исследования с применением различных методик операции (лазерная вапоризация, электрокаутеризация) показали, что развитие периовариальной адгезии зависит от объема повреждения поверхности яичников. Частота адгезии варьирует от 20 до 80%, а овуляция восстанавливается у 50 — 90% пациенток в зависимости от используемой методики [27, 54]. Для уменьшения повреждения яичников используется лапароскопическая техника. Некоторые авторы рекомендуют уменьшать число диатермических точек, так как это приводит к снижению адгезии и достижению беременности в большом проценте случаев [15]. Обнаружено, что даже при применении односторонней (на одном яичнике) диатермии овариальная активность повышается в обоих яичниках. При этом достигается коррекция нарушенной яичниково-гипофизарной обратной связи и восстанавливается нормальный гонадотропиновый контроль за работой яичников [18]. Операционная травма яичника, как полагают, приводит к активации локальной продукции факторов роста, в том числе ИРФ-1, которые во взаимодействии с ФСГ могут стимулировать рост фолликулов в нетравмированном яичнике [19]. Электрокаутеризация яичников вызывает эндокринные изменения, сходные с таковыми при введении аналогов ЛГРГ [10].
Нормализация гормонального статуса позволяет достигнуть овуляции, и может положительным образом влиять на состояние аденомы гипофиза. В клинической практике (архив ЭНЦ РАМН — неопубликованные данные) отмечены случаи уменьшения размеров аденомы гипофиза или ее кистозного превращения после нормализации функции яичников. В то же время после удаления аденомы гипофиза может происходить обратное развитие СПКЯ [44].
Если у больной с нарушениями репродуктивной функции выявлена асимптомная микроаденома гипофиза, ее хирургическое лечение не показано. В таких случаях для контроля возможного роста опухоли рекомендуется наблюдение с использованием МРТ в динамике [39].
Хирургические методы лечения при НАГ применяют при развитии симптомов сдавления опухолью окружающих анатомических структур (в первую очередь зрительного нерва и гипофизарной ножки), а также при появлении у «неактивной> аденомы клинических или/и биохимических признаков повышенной гормональной активности, не поддающихся лечению консервативными методами. В настоящее время основным методом хирургического лечения НАГ является транссфеноидальное удаление аденомы [8, 39]. В случаях рецидива опухоли применяют послеоперационную радио- или протонотерапию.
Восстановление менструальной функции после оперативного лечения НАГ отмечено у 55% пациенток [14]. Благоприятными прогностическими факторами при хирургическом лечении НАГ являются 1) размеры аденомы менее 40 мм, 2) период аменореи менее 5 лет, 3) нормальный уровень гонадотропиновой секреции до операции.
Попытки консервативной терапии НАГ связаны с использованием бромокриптина (БК) и других агонистов дофамина. Однако данные разных исследователей о влиянии БК на размеры НАГ существенно различаются. Некоторые авторы приходят к выводу о нецелесообразности лечения НАГ препаратами БК [21], тогда как другие [46] указывают на уменьшение опухолей в размерах при использовании БК. Сходный терапевтический эффект описан при применении октреотида (аналог соматостатина), а также бусерелина (агонист ЛГРГ). В среднем уменьшение размеров опухоли наблюдалось в 17% случаев независимо от применяемого препарата и соответствовало эффекту при лечении БК (около 20% случаев) [8]. Как отмечено выше, действие агонистов ЛГРГ при его длительном применении основано на подавлении уровня ЛГ и ФСГ и снижении уровня половых стероидов в крови, что может способствовать восстановлению нарушенных взаимосвязей гипофиза и яичников. Однако длительное использование аналогов ЛГРГ приводит к «десенситизации> рецепторов в ткани аденомы [42]. Антагонисты ЛГРГ, в отличие от агонистов, вызывая те же эффекты, действуют немедленно после их назначения, без начального стимулирующего эффекта [37]. Эффективность применения агонистов ЛГРГ при НАГ до конца не изучена, и данные, имеющиеся в литературе, носят противоречивый характер [8, 46]. Эффективность антагонистов ЛГРГ при этой патологии пока не исследована.
В заключение следует отметить, что выявление НАГ нередко представляет значительные трудности и предполагает тщательную оценку клинической картины, большой спектр гормональных исследований и проведение фармако-динамических проб. Ведение больных с патологией репродуктивной системы в сочетании с НАГ включает длительное динамическое наблюдение за состоянием турецкого седла и самой аденомы методами КТ или МРТ, многократное исследование гормонального статуса, а также избирательный подбор терапевтических средств для коррекции патологии репродуктивной системы с учетом их возможного влияния на аденому гипофиза.